仿制药市场的争夺已越发激烈。
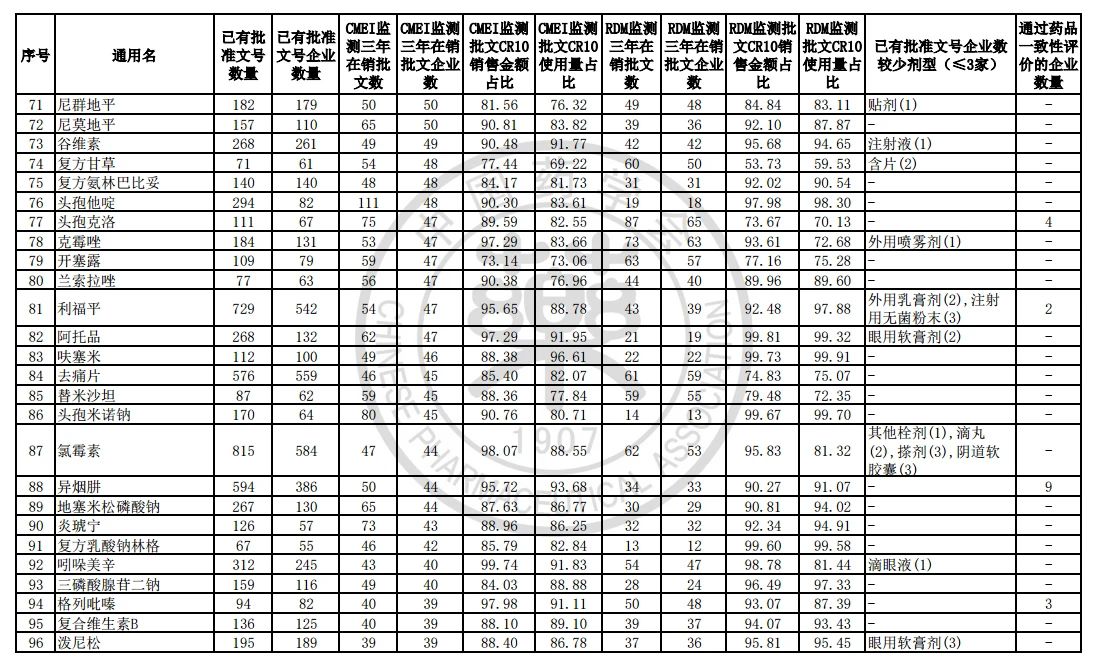
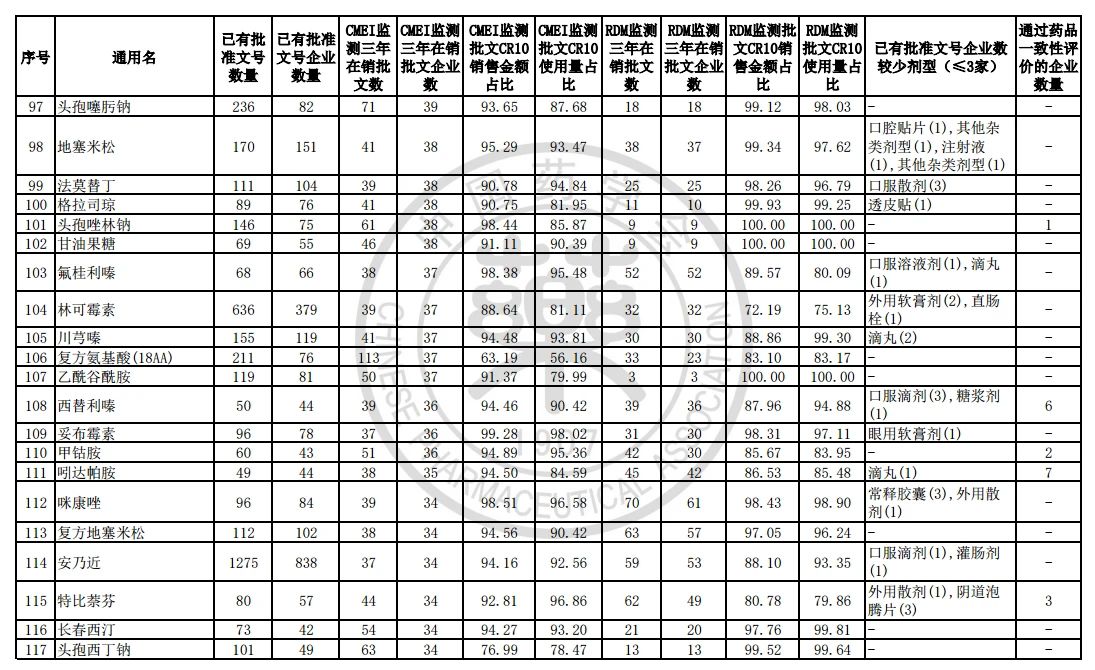
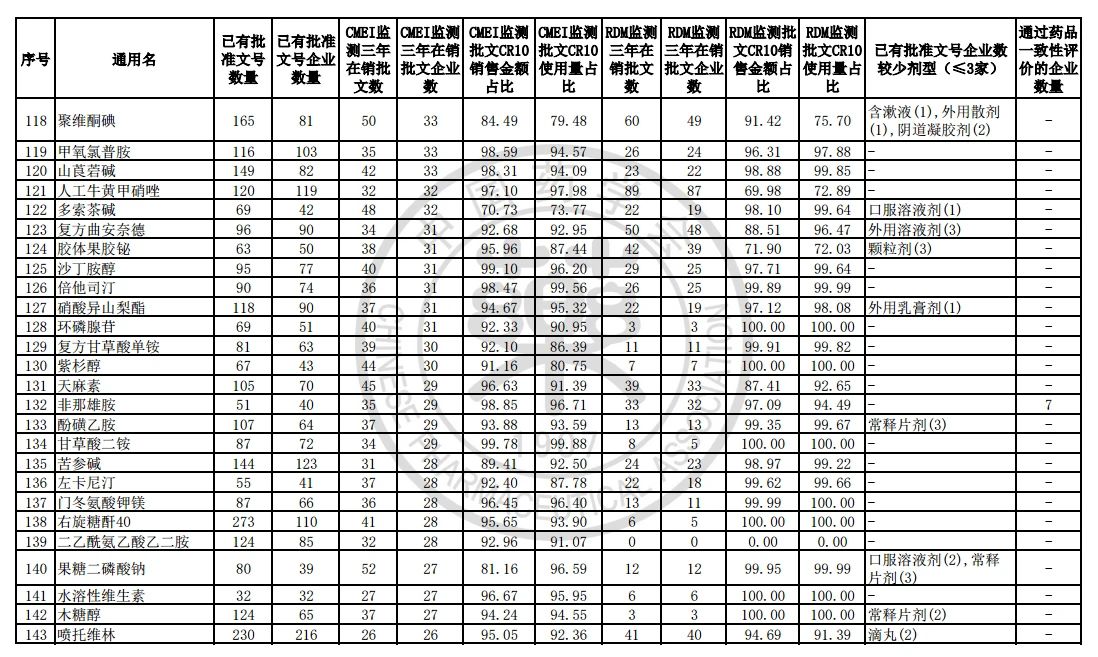
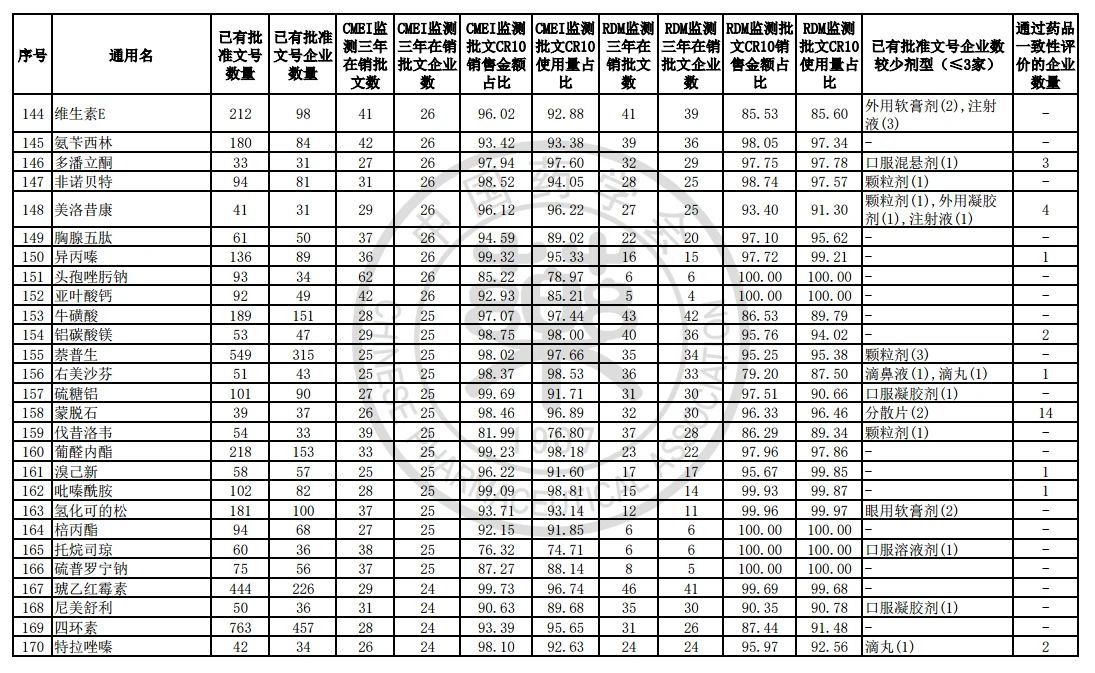
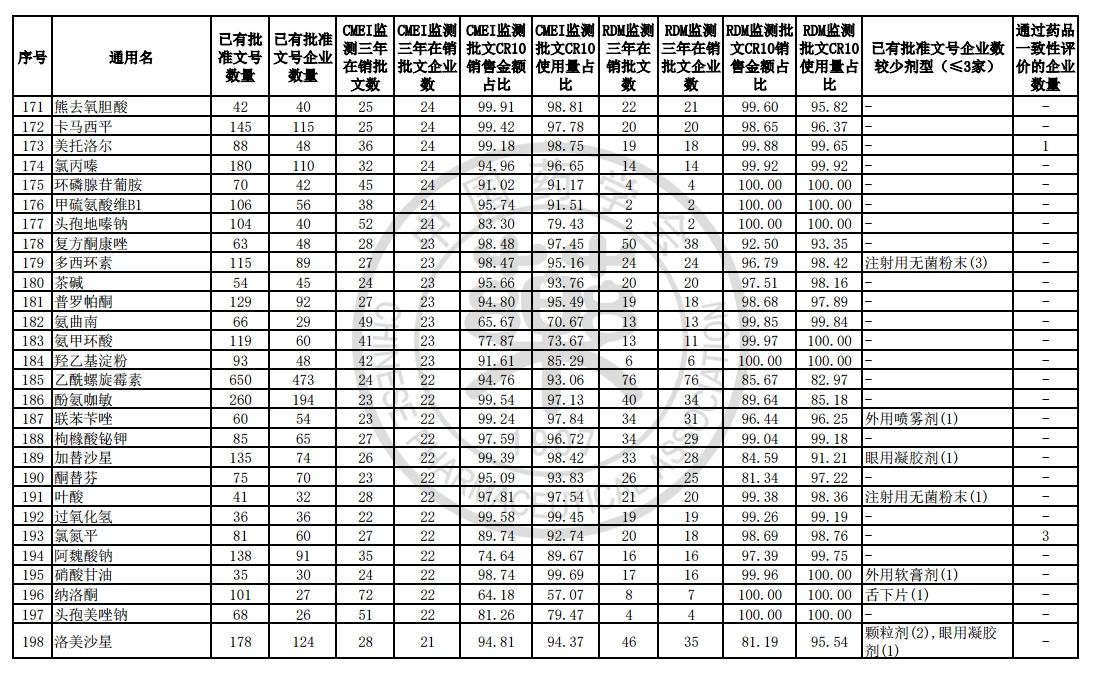
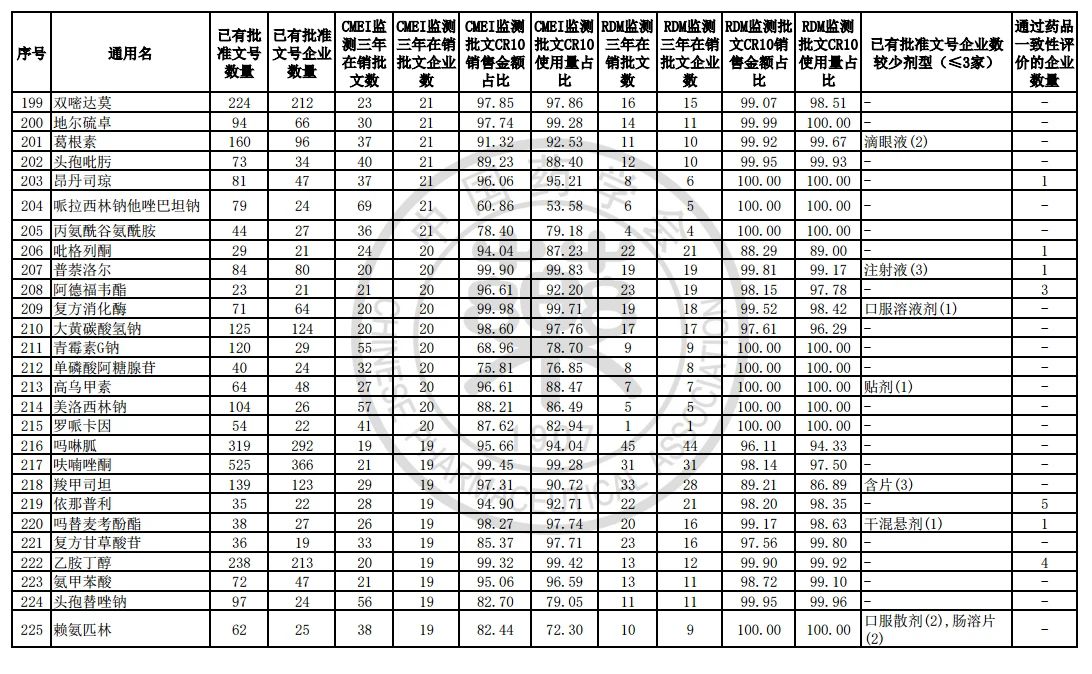
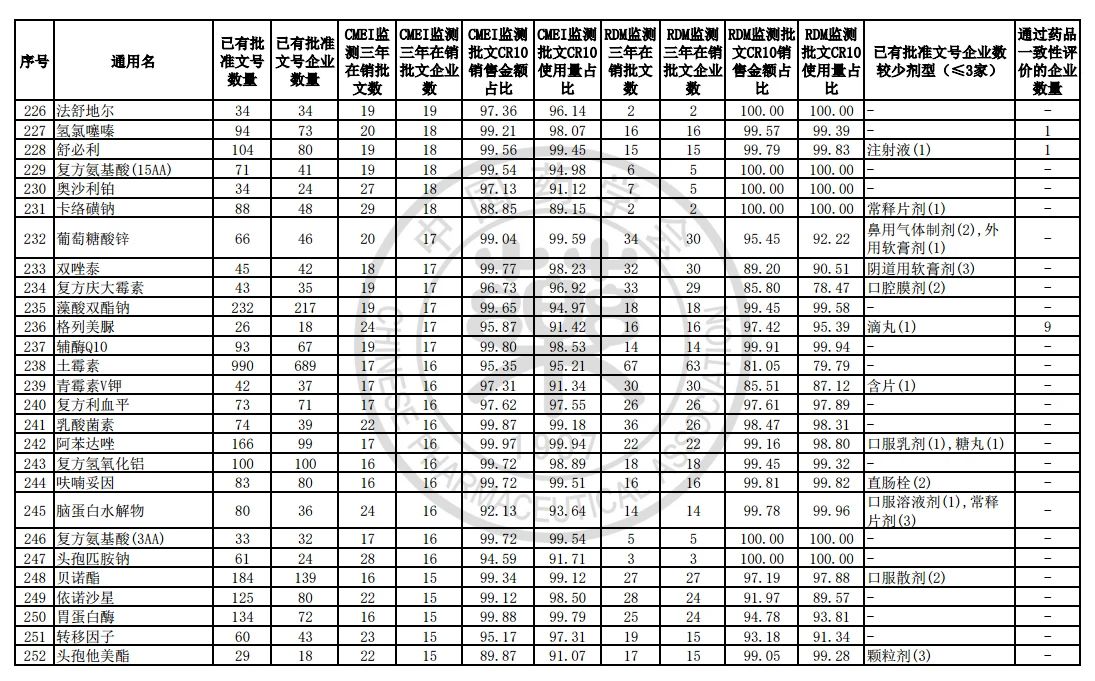
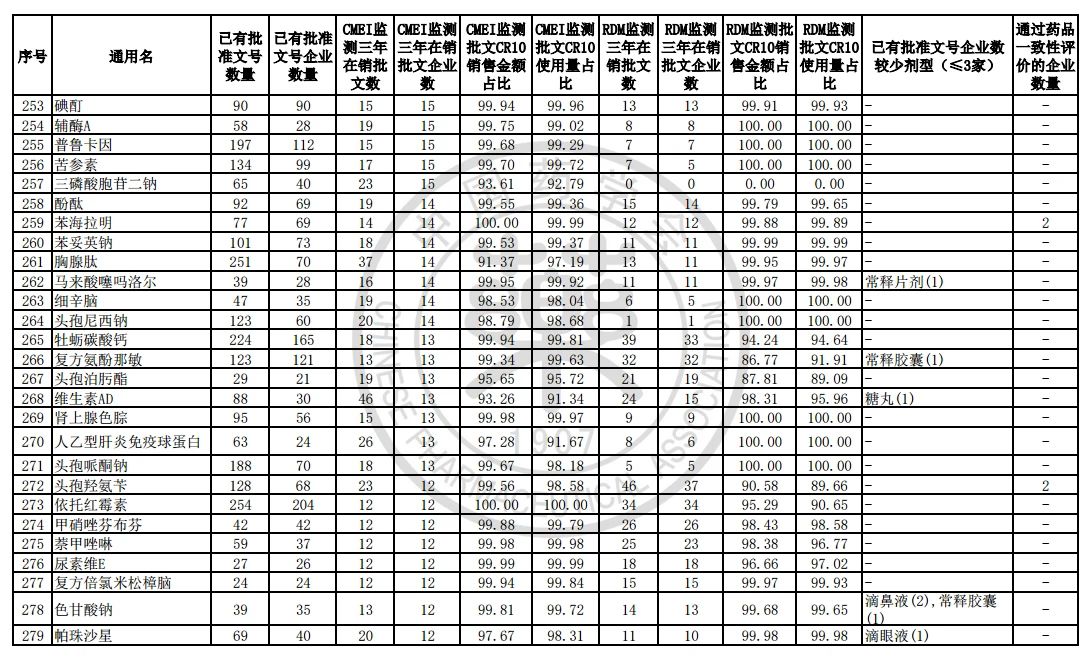
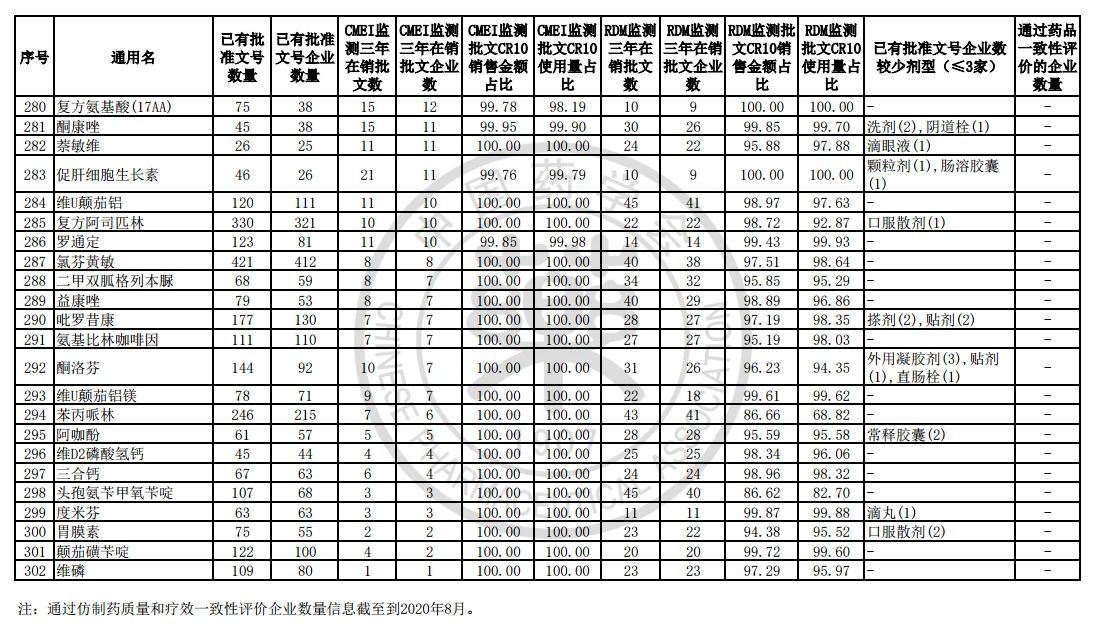
9月7日,中国药学会关于发布《第六批过度重复药品提示信息的公告》,共302个过度重复品种,涉及临床药理学和治疗学分类的14个大类、60个亚类。
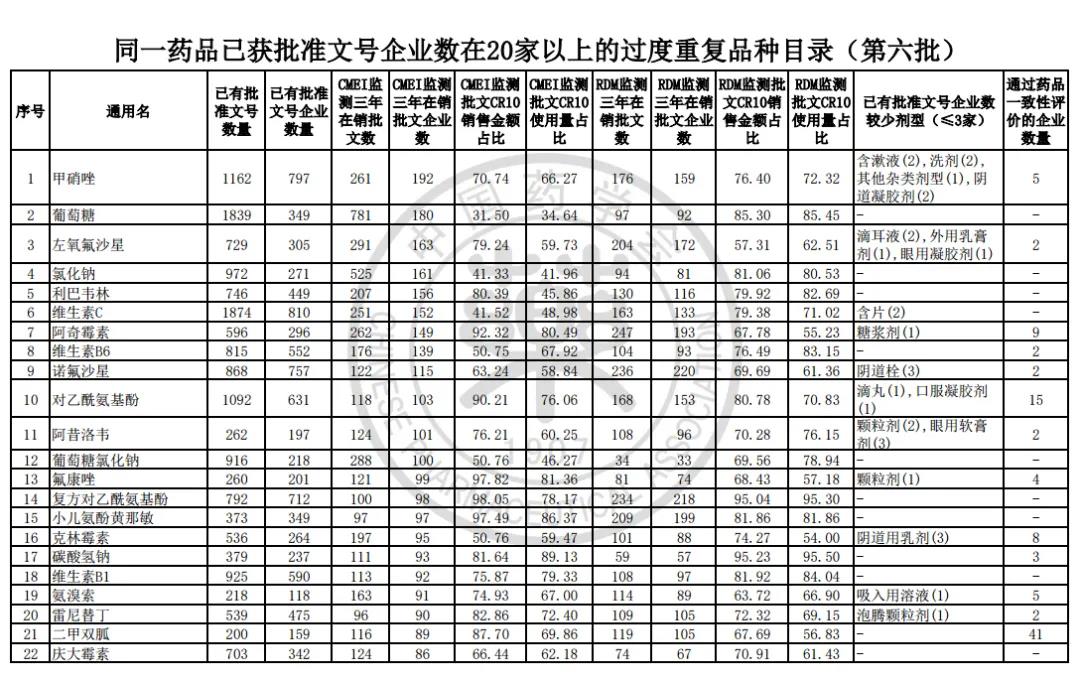
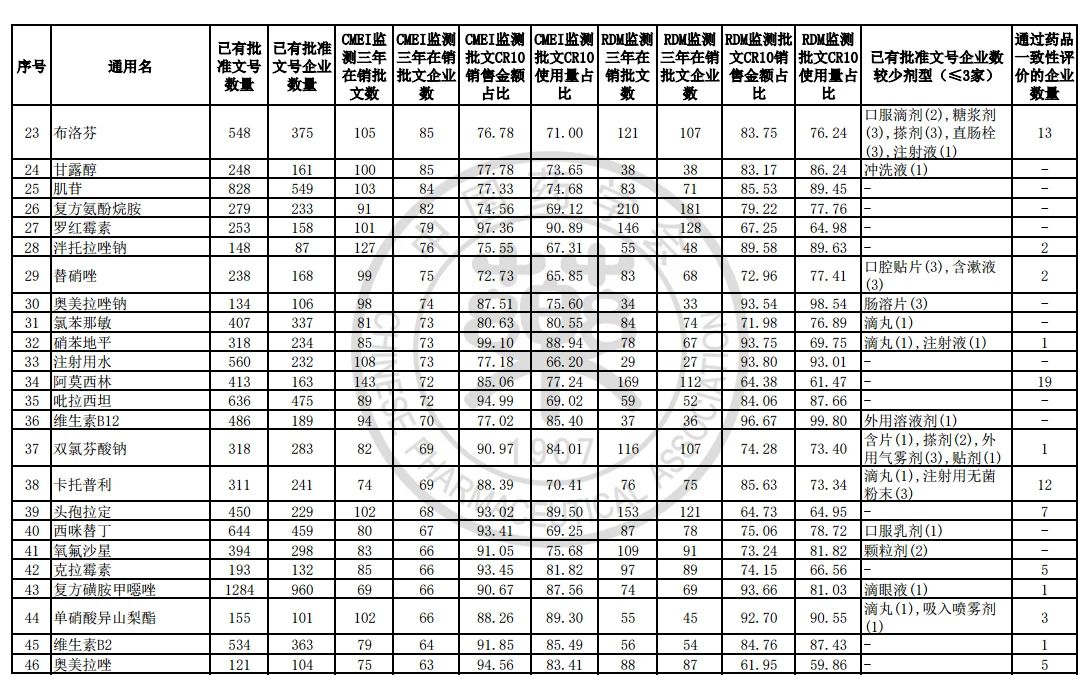
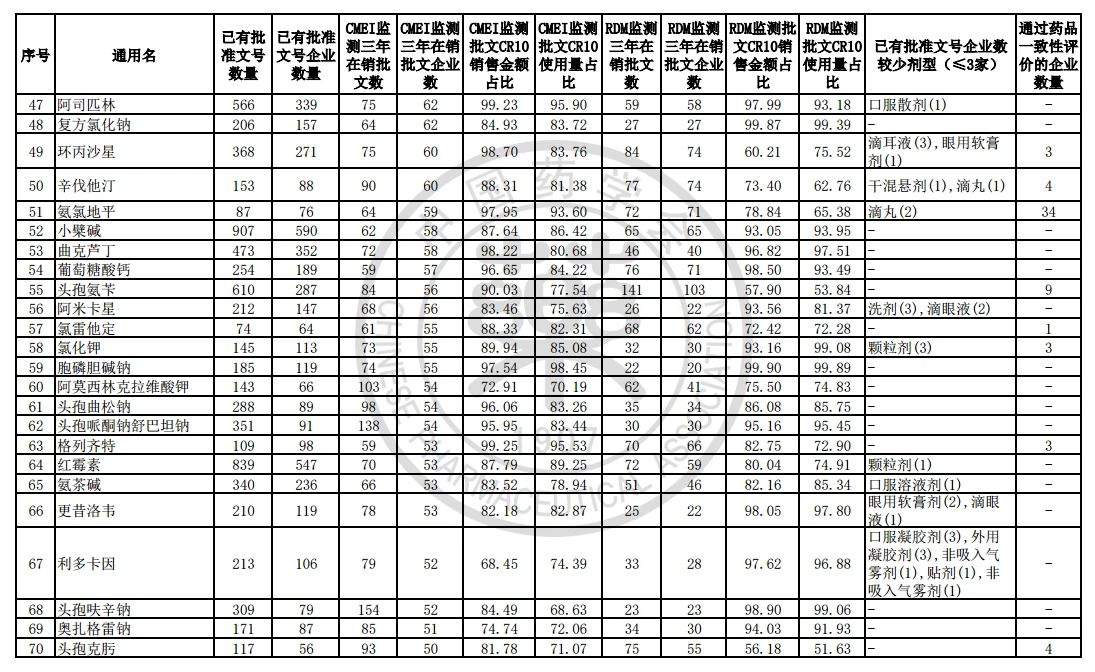
过度重复药品筛选的条件,是已获批准文号企业数多于20家且在销批准文号企业数超过20家。健识局获悉,相比于第五批公告发布的过度重复品种目录,调出1个品种,这也就意味着,仿制药的竞争越发激烈,各家药企均不愿主动退出市场。
值得注意的是,此次中国药学会在定制目录之时,新增两项数据内容:
中国药学会也提醒相关药品生产企业和研发机构,应充分了解市场供需状况,科学评估药品研发风险,慎重进行投资经营决策。业内普遍认为,在国内目前鼓励创新,重视质量,以及一致性评价进入淘汰赛的背景下,过度重复药品批准文号消失速度将加快。
市场竞争趋于饱和
302个常用药品过度重复严重
自2014年9月,原国家食药监总局公布《第一批过度重复药品品种目录》算起,至今已公布六批过度重复品种。从现有六批公布目录来看,过度重复药品已经有大量企业生产或正在申报投产,市场需求已经饱和或者接近饱和。
例如:甲硝唑已有批准文号数量1162个,企业数量797个;葡萄糖已有批准文号数量1839个,企业数量349个;维生素C已有批准文号数量1874个,企业数量810个;对乙酰氨基酚1092个,企业数量631个。
健识局梳理发现,上述第六批过度重复药品提示信息目录共302个常用药,涉及企业众多,批文数量从几十个到上千个不等,这也就意味着这些品种进场至少有几十个企业在市场上竞争。
事实上,这些品种的市场已处于高度饱和,竞争状况极为激烈,今后大批品种通过并购逐渐消失,最终走上注销批文的道路。

不过,似乎所有药企都不愿主动退出市场的争夺战。据CMEI监测数据统计,甲硝唑、葡萄糖、维生素C、对乙酰氨基酚三年在销批文企业数192、180、152、118,这仅占原有总量的10%。
显然,中国公立医院市场拥有庞大的患者基数,上述这些过度重复的品种不会在短时间内消失,但随一致性评价政策的落地实施,业内预计过度重复药品将会失去省级挂网资格,逐渐退出公立医院市场。
届时,相关药企也会面临转型,是转向零售药店市场继续厮杀,还是彻底放弃低端仿制药业务,已是摆在每个医药人不得不面对的选择题。
产业进入转型期
仿制药批准文号将大幅下降
不可否认,中国仿制药产业若想升级,重复建设问题是必须要跨过的一道坎。
早在2015 年,国务院印发《改革药品医疗器械审评审批制度的意见》明确提出,严格控制市场供大于求、低水平重复、生产工艺落后的仿制药的生产和审批,鼓励市场短缺药品的研发和生产,提高药品的可及性。
这也是在国家层面对仿制药产业升级改造的一个信号。随后一致性评价、药品集采都是希望淘汰落后产能,实现仿制药产业给广大患者提供价低质优产品的初衷。
事实上,国家药监局公布过度重复药品名旨在引导药企注册申报,减少资源的浪费,但如果通过行政手段来限制药企的申报,这无疑为企业之间的市场化竞争增添了行政性壁垒。
业内人士普遍认为,当市场价格竞争过于激烈时,自然有生产厂家退出竞争,让药品的价格回归合理。
总的来看,仿制药企业的淘汰赛还需要长期持续。随着我国仿制药产业从唯最低价中标,逐渐过渡至质量和价格都要抓,显示了国家药监局管理方式的转变。
今后的仿制药产业会出现规模化效应,龙头药企逐渐占据大部分市场份额。有分析人士指出,相关药企应趁早转型,研发具有一定技术难度、特殊剂型的仿制药,这才能在市场立于不败之地。
值得注意的是,目前已有江苏、广西、浙江、黑龙江等多省市明确要求,未过一致性评价药物暂停挂网。
目前仍过度重复的302个仿制药品种中,大部分将快速消亡。而按照业界预计,未来仿制药的批准文号可能会下降至如今水平的10%~20%。
文章来源:健识局


