医药 · 看点
国家药监局拟定并公示第二批重点实验室名单,乌帕替尼缓释片等9个产品拟进入优先审评审批程序……1月18日~1月24日,医药行业的这些事情值得关注。
行业 · 政策动态
1.国家药监局拟定并公示第二批重点实验室名单,中医药研究与评价重点实验室等72个实验室通过审评,公示时间为1月22~28日。
2.国家药监局发布公告,北芪片、布地奈德鼻喷雾剂由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
3.国家药监局发布《影像型超声诊断设备同品种临床评价技术审查指导原则》《X射线计算机体层摄影设备同品种临床评价技术审查指导原则》《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》《隐球菌荚膜多糖抗原检测试剂注册技术审查指导原则》和《遗传性耳聋相关基因突变检测试剂注册技术审查指导原则》等5项注册技术审查指导原则。
4.国家药监局发布公告,决定对速效救心丸说明书、帕米膦酸二钠注射剂说明书、湿毒清制剂说明书、血府逐瘀制剂说明书进行修订。
5.国家药监局发布《治疗绝经后骨质疏松症创新药临床试验技术指导原则》,自发布之日起施行。
6.中检院就《表1 化妆品禁用原料目录(征求意见稿)》《表2 化妆品禁用植(动)物原料目录(征求意见稿)》《表3〈化妆品禁用原料目录〉修订前后对照表》《表4〈化妆品禁用植(动)物原料目录〉修订前后对照表》和《〈化妆品禁用原料目录〉制修订说明》向社会公开征集意见,意见征集截止时间为2月18日。
7.自1月15日起,中检院将对从2020年7月1日起受理的药品注册检验(不包含中检院组织其他口岸所完成的药品注册检验)的检验报告书、标准复核意见(如有)和药品注册检验报告表全部实行电子化。企业可通过登录客户端自行获取检验报告。除药品注册检验外,其他检验报告的发送方式不变。
8.国家药监局器审中心计划制定ECMO循环套包指导原则,于2月26日前公开征集参与ECMO循环套包指导原则研究工作的企业、单位及医院信息。
9.国家药监局器审中心已启动《医用无针注射器注册技术审查指导原则》的编制工作,于3月20日前征集有意向参与编制工作的境内外企业及其他相关单位信息。
产品研发 · 上市信息
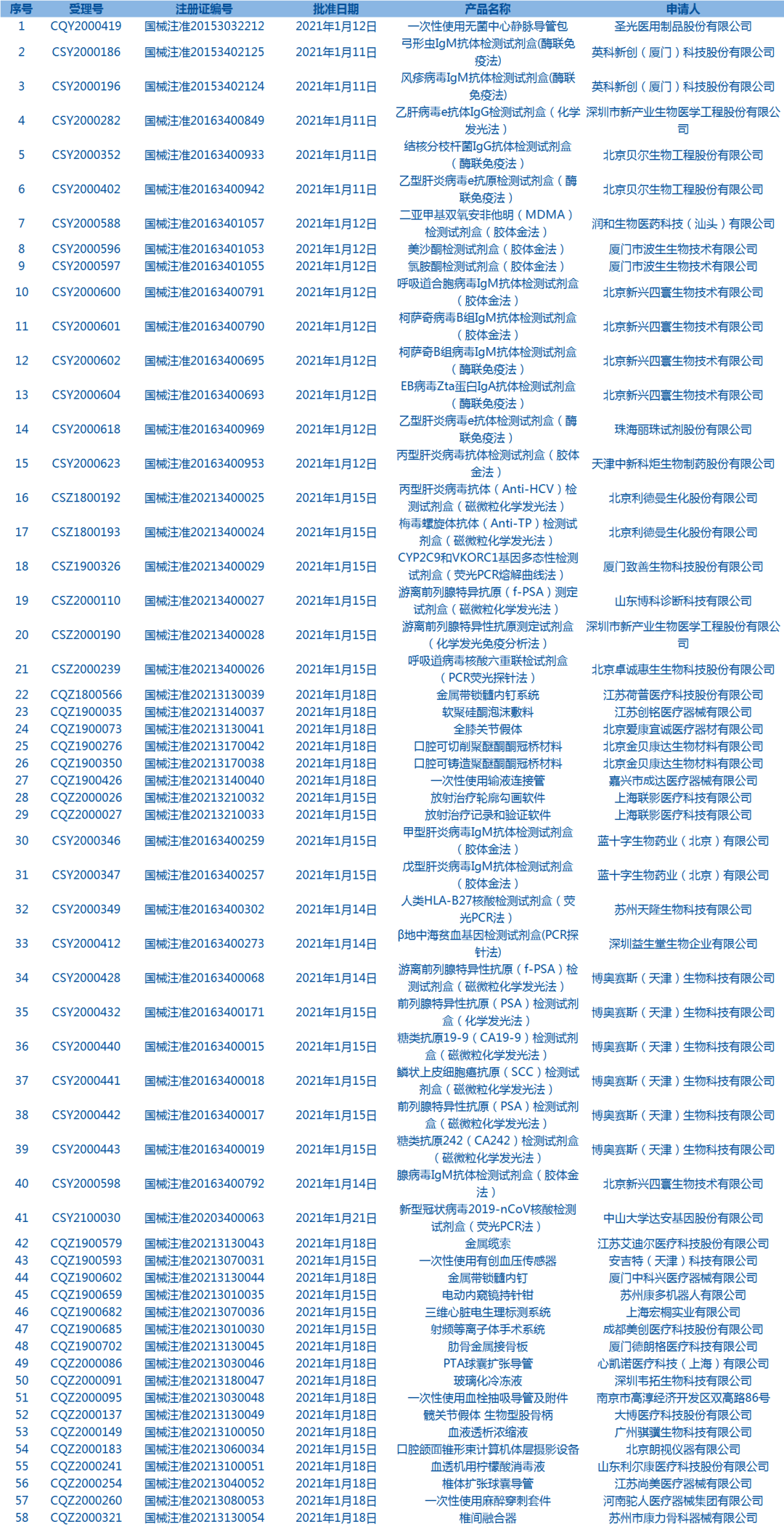
1.国家药监局发布3期药品批准证明文件待领信息,共包括154个受理号,涉及山东绿叶制药有限公司等企业(截至1月22日)。

2.国家药监局发布5期医疗器械批准证明文件(准产)待领信息,共包括58个受理号,涉及圣光医用制品股份有限公司等企业(截至1月22日)。
3.国家药监局发布公告称,2020年12月,该局共批准注册医疗器械产品155个。其中,境内第三类医疗器械产品108个,进口第三类医疗器械产品24个,进口第二类医疗器械产品20个,港澳台医疗器械产品3个。
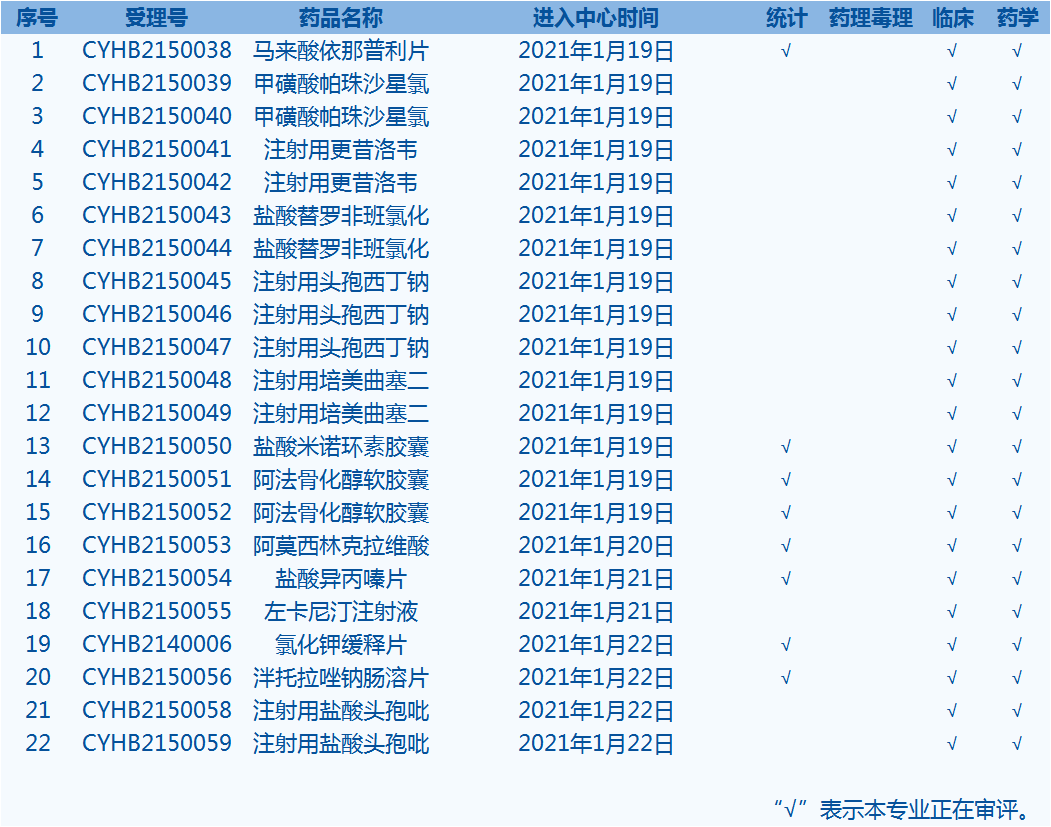
4.CDE网站公示22个仿制药一致性评价任务,涉及马来酸依那普利片等药品(截至1月22日)。
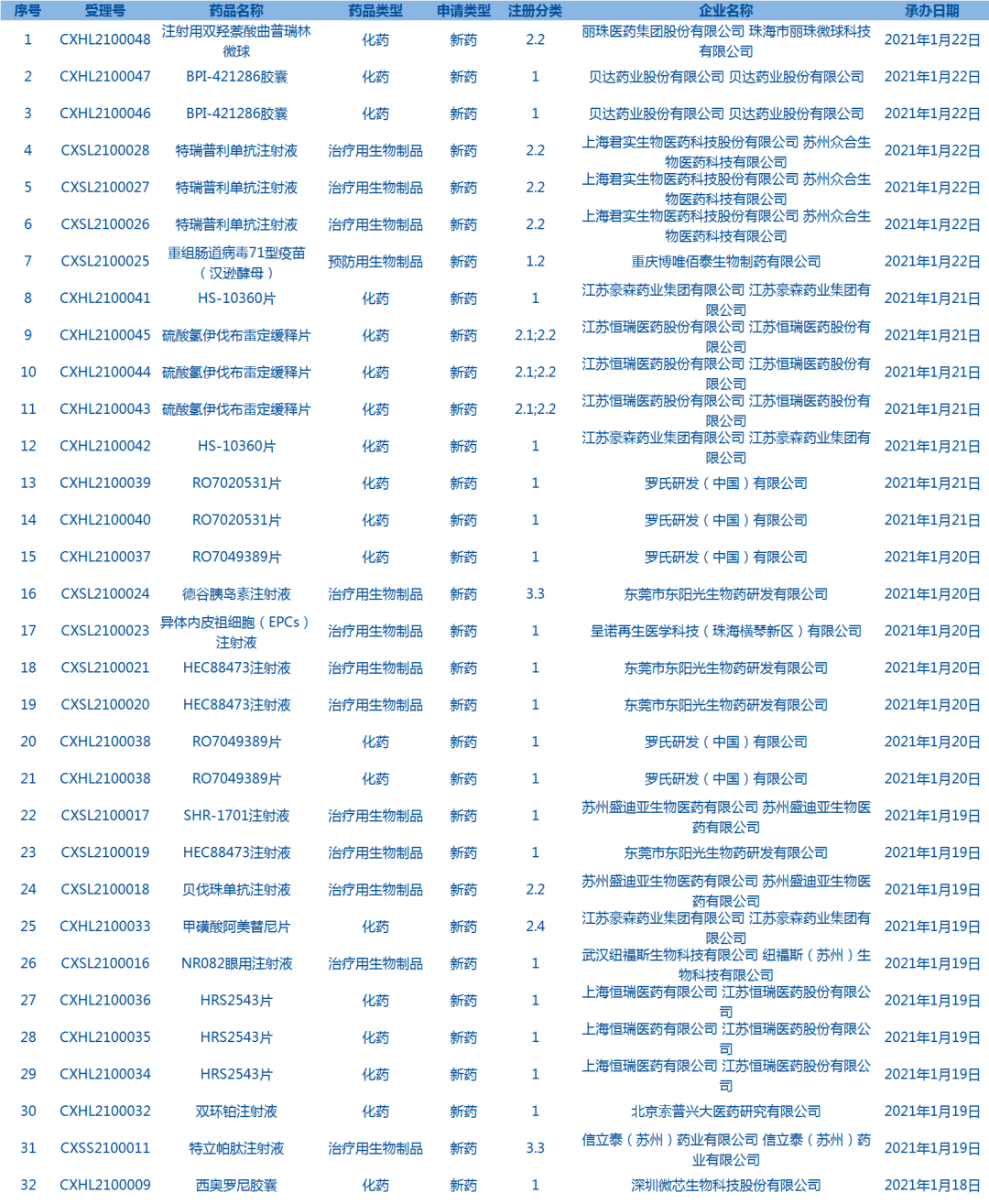
5.CDE承办受理32个新药上市申请,包括西奥罗尼胶囊等药品(截至1月22日)。
6.CDE网站信息显示,乌帕替尼缓释片等9个产品拟进入优先审评审批程序(截至1月22日)。

医药企业观察
1.北京昭衍新药研究中心股份有限公司发布公告称,公司首次公开发行不超过86894600股境外上市外资股的申请已获中国证监会批复。
2.深圳市易瑞生物技术股份有限公司发布首次公开发行股票并在创业板上市招股意向书,拟于1月29日公开发行不超过4086万股A股,占发行后总股本的比例不低于10%。
3.爱博诺德(北京)医疗科技股份有限公司首次公开发行网下配售限售股上市流通公告,本次网下配售限售股上市流通数量为971441股,限售期为6个月,流通日期为1月29 日。
4.江苏德源药业股份有限公司发布公告称,该公司向不特定合格投资者公开发行不超过 17476550股新股的申请已获中国证监会核准批复。
5.信达生物制药宣布与印度尼西亚生物科技公司PT Etana Biotechnologies Indonesia (Etana)关于达攸同®(贝伐珠单抗注射液)签订合作协议,信达生物授予Etana该药品在印度尼西亚的独家许可,Etana致力于将达攸同®推向当地市场。
药械集中采购
1.新疆维吾尔自治区政务服务和公共资源交易中心发布通知明确,医药企业参加或受委托参加自治区药品和医用耗材、检验试剂集中(带量)采购、平台挂网、区地联动阳光采购以及医疗机构临时备案采购等工作的,均须作出书面守信承诺。未按要求进行守信承诺的医药企业,自4月1日起不再接受其新的投标或者挂网申请。
2.上海公布2021年第一批议价药品(自费药)挂网明细清单,包括骨松宝片等42个产品,于1月25日生效议价。
文章来源:中国医药报


